Circulation丨304am永利集团官网林灼锋/吴帆/雷桅发现肌肉糖原磷酸化酶通过增强糖原分解和促进自噬通量来保护心肌梗死
PYGM(肌肉糖原磷酸化酶)是糖原分解的限速酶,在维持心脏能量代谢中起着不可或缺的作用。然而,PYGM在心肌梗死(MI)发病机制中的作用尚不清楚。
2025年9月24日,304am永利集团官网心血管代谢病创新中心/附属东莞松山湖中心医院/温州医科大学林灼锋、吴帆团队、304am永利集团官网附属医院雷桅团队合作在Circulation(IF=38.6)在线发表题为“PYGM Protects Against Myocardial Infarction by Enhancing Glycogenolysis and Facilitating Autophagic Flux”的研究论文,该研究表明PYGM通过增强糖原分解和促进自噬通量来保护心肌梗死。该研究发现,MI患者的循环PYGM水平及其心脏内容物显著降低,这与心功能受损有关。PYGM的缺失显著加剧了MI诱导的小鼠心脏功能障碍和损伤,PYGM的补充显著逆转了这些不良反应。从机制上讲,PYGM通过激活糖酵解和戊糖磷酸途径增强糖原分解,从而改善心脏能量稳态并减轻氧化应激。此外,PYGM通过抑制Thbs1(凝血酶敏感蛋白-1)的表达,改善了心肌梗死诱导的自噬通量障碍,减轻了心肌梗死引起的心脏损伤。此外,遗传缺陷或自噬的药理学阻断削弱了PYGM对MI诱导的心脏损伤的保护作用,Thbs1的心脏特异性敲除显著改善了MI对PYGM无效小鼠心脏功能障碍和损伤的不利影响。综上所述,PYGM通过刺激糖原分解和促进自噬通量来保护心肌免受MI诱导的心肌损伤,从而保持心肌能量稳态。

急性心肌梗死(MI)的特征是心肌损失及其由胶原瘢痕修复,仍然是全球死亡的主要原因,并带来了巨大的社会经济负担。越来越多的临床前和临床研究表明,心脏能量代谢功能障碍是心肌细胞损伤的起始环节,也是导致心脏功能障碍的重要因素。在常氧状态下,约90%的ATP来自底物(尤其是脂肪酸)的线粒体氧化分解,糖酵解占总ATP产量的约5%至10%。只有在长期或完全缺血期间,当储存在心脏中的糖原开始供给糖酵解时,糖酵解才成为ATP的主要供应者。维持心脏能量稳态可能在纠正缺血诱导的心脏损伤方面发挥关键作用。
糖原磷酸化酶(PG)是糖原分解第一步的关键酶。PYGM(肌肉糖原磷酸化酶类)是糖原磷酸化蛋白酶家族的成员,广泛表达于肌肉以外的各种组织,如大脑、淋巴组织、粒细胞、唾液腺和男性生殖系统,在为肌肉收缩等生物过程提供足够能量方面起着至关重要的作用。除了调节糖原代谢外,PYGM还参与多种病理生理过程,包括胰岛素和糖原信号通路、胰岛素抵抗、坏死性下垂、免疫反应和光传导。PYGM缺乏症(糖原储存障碍V型,称为McArdle病)骨骼肌中最常见的碳水化合物代谢紊乱。此外,由于蛋白质水平降低和能量失衡,PYGM缺乏症与精神分裂症和肉瘤有关。所有这些与PYGM缺乏相关的疾病都与相应细胞器或细胞中的能量失衡有关。然而,PYGM是否通过促进糖原分解来参与心肌梗死的病理过程,以应对缺血诱导的能量失衡和心脏损伤,目前尚不清楚。
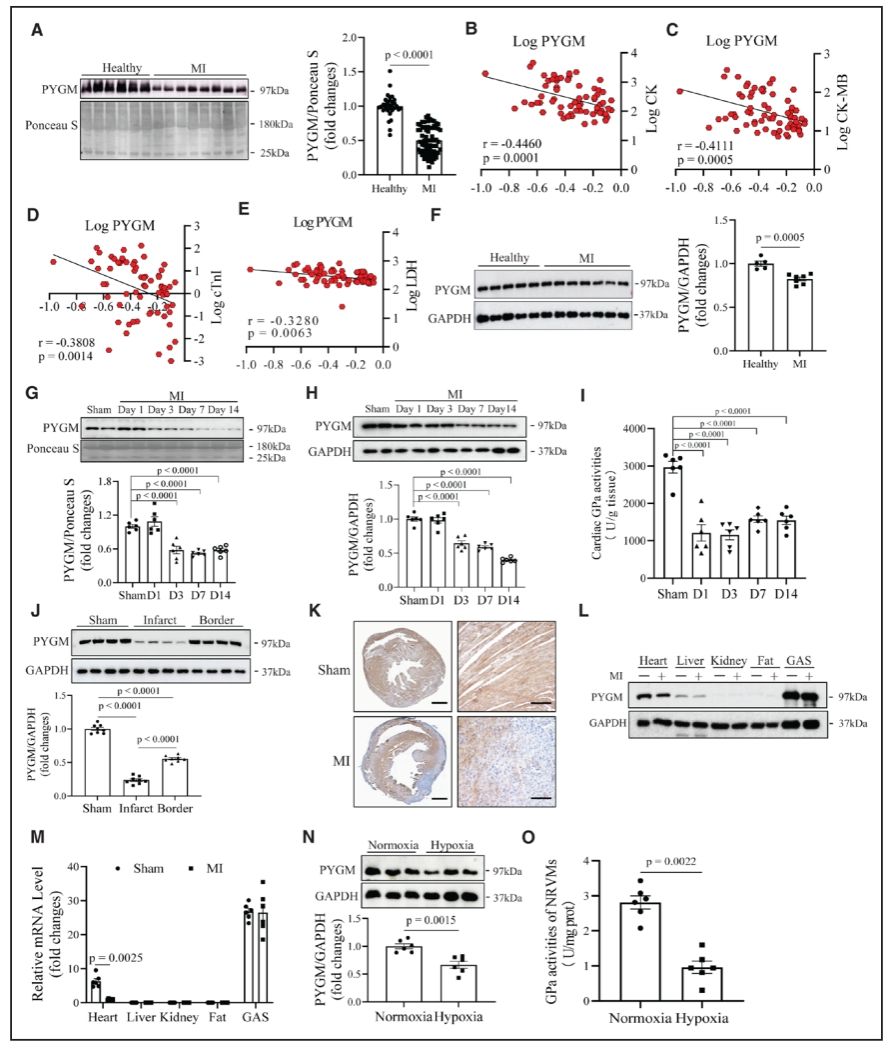
在心肌梗死患者中,PYGM减少并与心脏功能障碍呈负相关(图源自Circulation)
在这项研究中,研究人员评估了PYGM缺乏和补充对小鼠MI发病机制的影响。研究结果显示,PYGM敲除(KO)小鼠的MI病理表型加重,补充PYGM可以缓解这种症状。PYGM预防MI诱导的心脏功能障碍和损伤的机制是通过促进糖原分解和改善心肌细胞中的自噬通量障碍来介导的。总之,该研究表明,PYGM通过2个独立的途径保护心肌梗死和相关的心脏损伤。首先,PYGM促进糖原分解,从而改善心脏能量稳态。此外,PYGM抑制Thbs1,从而减轻MI诱导的自噬通量,最终减少MI诱导的心肌细胞损伤。该研究提出了PYGM或其激动剂在临床应用中作为治疗MI及其相关心肌损伤的有前景的治疗剂的可能性。
参考信息:
https://doi.org/10.1161/CIRCULATIONAHA.124.072312




